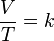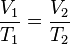Cada
molécula de un gas real se mueve en línea recta, hasta que choca con otra
molécula o con el recipiente.
Por ejemplo: A 25 °C y a presión
atmosférica, una molécula de gas real característico choca con otra molécula
unas 10¹°
veces por segundo, por lo que su trayectoria es totalmente aleatoria.
Dato curioso
* El movimiento aleatorio
se llama movimiento browniano y fue observado por primera vez por el botánico
escocés Robert Brown.

Trayectoria aleatoria de una molécula de gas real.
|
*Las moléculas de los gases
reales sólo recorren unos 10-5 cm entre colisiones.
Como una molécula de gas
sufre choques frecuentes, su velocidad cambia con la frecuencia. Como cualquier
muestra de gas que contiene una cantidad muy grande de moléculas, no es posible
predecir la velocidad de determinada molécula, pero si la distribución de las
velocidades de las moléculas.
Dato curioso
* Un gas
contiene unas 10 ²² moléculas
por litro a temperatura ambiente y a presión atmosférica.
Hablando de velocidad...
James Clerk Maxwell, físico inglés, calculó que la fracción de las moléculas con determinada velocidad varía en función de la velocidad.
Este gran aumento en la cantidad de moléculas que se mueven a velocidades muy altas, al aumentar la temperatura, tiene extrema importancia, porque las moléculas de movimiento muy rápido y gran energía son las que tienen más probabilidad de participar en las reacciones químicas.
¿Y si hablamos de presión?
La presión sobre las paredes del recipiente se debe a que las moléculas del gas chocan contra ellas. La presión depende de la cantidad de veces que chocan las moléculas de gas con una unidad de área de la pared y de su velocidad al chocar. Cuanto mayor sea la cantidad de moléculas en el gas, habrá más colisiones con las paredes del recipiente y la presión será mayor. Si se aumenta el volumen del recipiente, las moléculas deben moverse más entre colisiones con las paredes, por lo que no chocan con ellas con tanta frecuencia y la presión disminuye.
Dentro de la presión podemos incluir la temperatura, ya que, al aumentar la temperatura, se incrementa la velocidad de las moléculas. Éstas chocan con las paredes con más frecuencia y con mayor velocidad; por consiguiente aumenta la presión
Bibliografía: Química general. Jean B. Umland, Jon M. Bellama.
Ed: Thomson learning